Esteban Mocskos, profesor e investigador del DC, publicó en co autoría el artículo ‘Long-Lived Binding of Sox2 to DNA Predicts Cell Fate in the Four-Cell Mouse Embryo’.
El trabajo aparece en la revista de biología Cell, una de las más prestigiosas a nivel mundial, y tuvo el privilegio de ser elegido como tapa de la revista, lo cual presupone un reconocimiento académico adicional. La investigación es llevada a cabo con otros miembros de la Facultad de Ciencias Exactas y Naturales y, al mismo tiempo, participan institutos extranjeros.
La contribución del Dr. Mocskos desde la disciplina de modelado y simulación computacional reafirma el valor de encarar proyectos interdisciplinarios realizando aportes desde las ciencias de la computación.
La revista Cell se encuentra entre las 10 publicaciones con mayor visibilidad en todas las áreas de la ciencia a nivel internacional, lo cual resulta un motivo de orgullo para el Departamento de Computación.
Resumen
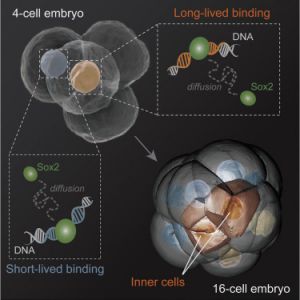
El factor de transcripción (TF) del ADN es fundamental para la regulación de los genes. Sin embargo, se desconoce cómo la dinámica de TF-ADN cambia durante las interacciones célula-destino en su determinación in vivo. Aquí, utilizamos la técnica foto-activable FCS para cuantificar TF-ADN en células individuales de desarrollo de embriones de ratón. En blastocitos, el TFs Oct4 y SOX2, que controlan la pluripotencia, enlazan de manera más estable el ADN en las células pluripotentes que en las células extra embriónicas.
Por el contrario, en el embrión de cuatro células, SOX2 se acopla en más interacciones de larga duración que Oct4. El Sox2 unido de larga duración varía entre blastómeros y está regulado por la metilación H3R26. El seguimiento de la célula viva demuestra que aquellos blastómeros con más larga duración contribuyen a mayor vinculación de progenie pluripotente y la reducción de H3R26 disminuye la metilación de larga duración, la expresión SOX2 de destino y los números de células pluripotentes.
Por lo tanto, la unión SOX2-ADN predice el destino de las células de mamífero tan pronto como en la etapa de cuatro células. En términos más generales, revelamos la dinámica reparticionando TFs entre sitios de ADN impulsada por cambios fisiológicos epigenéticos.
Link al artículo en CELL




